Actualizado septiembre 11, 2019
Imagínese despertarse en un día en el que tiene planeadas muchas cosas divertidas. ¿Alguna vez sucede que, a pesar del emocionante día que se avecina, necesitas reunir algo de energía extra para salir de la cama? Una vez que estás arriba, puedes pasar el resto del día, pero hay una pequeña joroba que debes superar para llegar a ese punto.

La energía de activación de una reacción química es algo así como esa «joroba» que tienes que superar para salir de la cama. Incluso las reacciones de liberación de energía (exergónicas) requieren cierta cantidad de energía para ponerse en marcha, antes de poder continuar con sus pasos de liberación de energía. Esta entrada de energía inicial, que luego se devuelve a medida que avanza la reacción, se llama energía de activación.
¿Qué es la Energía de Activación?
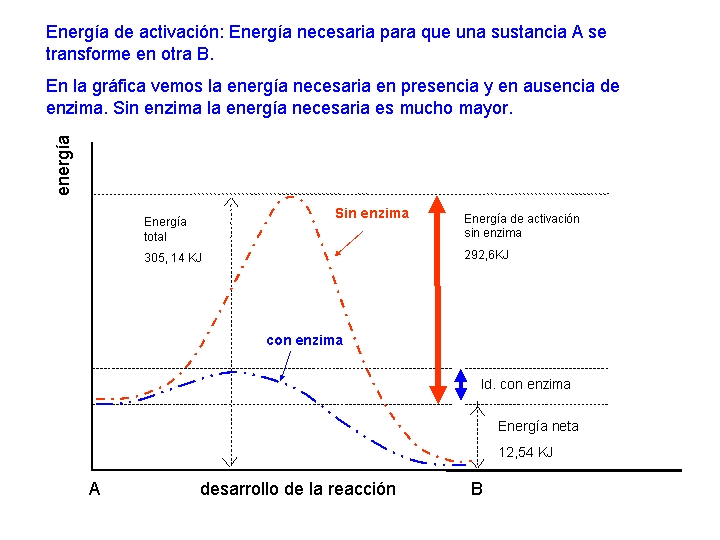
La Energía de activación, en química, es la cantidad mínima de energía que se requiere para activar los átomos o las moléculas a una condición en la que puedan experimentar transformaciones químicas o transporte físico. En la teoría del estado de transición, la energía de activación es la diferencia en el contenido de energía entre los átomos o moléculas en una configuración de estado de transición o activada y los átomos y moléculas correspondientes en su configuración inicial. La energía de activación suele estar representada por el símbolo Ea en expresiones matemáticas para cantidades tales como la constante de velocidad de reacción, k = Aexp (−Ea / RT) y el coeficiente de difusión, D = Doexp (−Ea / RT). Las energías de activación se determinan a partir de constantes de velocidad experimentales o coeficientes de difusión que se miden a diferentes temperaturas.
¿Cómo funciona la Energía de Activación?
Para que se produzca la reacción, algunos o todos los enlaces químicos en los reactantes deben romperse para que puedan formarse nuevos enlaces, los de los productos. Para obtener los enlaces en un estado que les permita romperse, la molécula debe estar contorsionada (deformada o doblada) en un estado inestable llamado estado de transición. El estado de transición es un estado de alta energía, y debe agregarse cierta cantidad de energía, la energía de activación, para que la molécula la alcance. Debido a que el estado de transición es inestable, las moléculas reactivas no permanecen allí por mucho tiempo, sino que pasan rápidamente al siguiente paso de la reacción química.
En general, el estado de transición de una reacción siempre está en un nivel de energía más alto que los reactivos o productos, de modo que Ea siempre tiene un valor positivo, independientemente de si la reacción es endergónica o exergónica en general. Si la reacción procediera de forma endergónica, el estado de transición seguirá siendo el mismo, pero la energía de activación será mayor. Esto se debe a que las moléculas del producto son de menor energía y, por lo tanto, necesitarían más energía agregada para alcanzar el estado de transición en la parte superior de la «colina» de reacción.
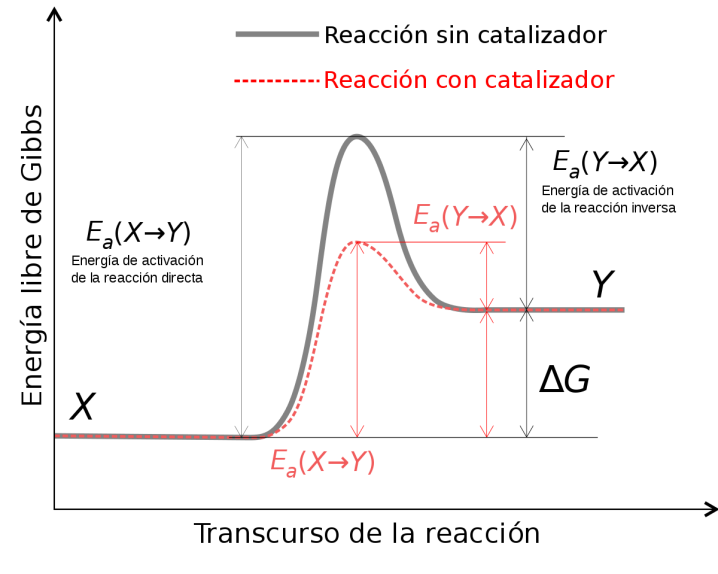
Aunque los productos están a un nivel de energía más bajo que los reactivos (la energía libre se libera al pasar de los reactivos a los productos), todavía hay una «joroba» en el camino energético de la reacción, lo que refleja la formación del estado de transición de alta energía. . La energía de activación para la reacción hacia adelante es la cantidad de energía libre que se debe agregar para pasar del nivel de energía de los reactivos al nivel de energía del estado de transición.
Aunque los productos están a un nivel de energía más bajo que los reactivos (la energía libre se libera al pasar de los reactivos a los productos), todavía hay una «joroba» en el camino energético de la reacción, lo que refleja la formación del estado de transición de alta energía. . La energía de activación para la reacción hacia adelante es la cantidad de energía libre que se debe agregar para pasar del nivel de energía de los reactivos al nivel de energía del estado de transición.
La fuente de energía de activación es típicamente el calor, con moléculas reactantes que absorben la energía térmica de su entorno. Esta energía térmica acelera el movimiento de las moléculas reactivas, aumentando la frecuencia y la fuerza de sus colisiones, y también empuja los átomos y enlaces dentro de las moléculas individuales, lo que hace más probable que los enlaces se rompan. Una vez que una molécula reactiva absorbe suficiente energía para alcanzar el estado de transición, puede proceder durante el resto de la reacción.
Energía de activación y velocidad de reacción
La energía de activación de una reacción química está estrechamente relacionada con su velocidad. Específicamente, cuanto mayor sea la energía de activación, más lenta será la reacción química. Esto se debe a que las moléculas solo pueden completar la reacción una vez que han alcanzado la cima de la barrera de energía de activación. Cuanto más alta es la barrera, menos moléculas tendrán suficiente energía para superarla en un momento dado.

Muchas reacciones tienen energías de activación tan altas que, básicamente, no proceden en absoluto sin un aporte de energía. Por ejemplo, la combustión de un combustible como el propano libera energía, pero la velocidad de reacción es efectivamente cero a temperatura ambiente. (Para que quede claro, esto es algo bueno: ¡no sería tan bueno si los recipientes de propano se queman espontáneamente en el estante!) Una vez que una chispa ha provisto suficiente energía para que algunas moléculas sobrepasen la barrera de energía de activación, esas moléculas completan la reacción , liberando energía. La energía liberada también ayuda a otras moléculas de combustible a superar la barrera energética, lo que lleva a una reacción en cadena.
La mayoría de las reacciones químicas que tienen lugar en las células son como el ejemplo de combustión de hidrocarburos: la energía de activación es demasiado alta para que las reacciones se realicen significativamente a temperatura ambiente. Al principio, esto parece un problema; después de todo, no puedes provocar una chispa dentro de una celda sin causar daño. Afortunadamente, es posible reducir la energía de activación de una reacción y, por lo tanto, aumentar la velocidad de reacción. El proceso de acelerar una reacción reduciendo su energía de activación se conoce como catálisis, y el factor que se agrega para disminuir la energía de activación se llama catalizador. Los catalizadores biológicos se conocen como enzimas, y los examinaremos en detalle en la siguiente sección.
Conclusión
Comprender y utilizar el concepto de energía de activación en nuestras vidas no requiere un título en química. Si bien el concepto utilizado por los científicos es complejo, podemos usar la idea básica.
No es una coincidencia que muchos de los modelos mentales más útiles en nuestra celosía se originen en la ciencia. Hay algo bastante poético en la forma en que el comportamiento humano refleja lo que ocurre a nivel microscópico.
Esperamos que nuestro articulo haya sido de gran ayuda. En caso de tener alguna duda y desees realizar una pregunta, diríjase a la parte inferior de nuestra pagina web y encontraras un sector donde podrás dejar un comentario. Lo leeremos a la brevedad e intentaremos ayudarte a que entiendas el tema y puedas entenderlo a la perfección.
Una vez que hayas entendido todo acerca de la energía de activación y su relación con la energía de reacción, te vamos a encargar que nos realices un favor que para usted tal vez sea pequeño pero para nosotros implica una enorme ayuda. Ademas, te pedimos por favor que compartas nuestro articulo en sitios como Facebook, Twitter o cualquier otra red social que frecuentes, ya que nos servirá para poder expandirnos y lograr aumentar nuestro alcance. Tus seguidores te lo agradecerán.
Hasta pronto!!!
Deja una respuesta