Actualizado septiembre 11, 2019
Le damos la bienvenida a todos nuestros lectores a un nuevo articulo de interés. En esta ocasión les brindaremos información acerca de la Energía Iónica; su definición, para que sirve, ejemplos, entre muchas otras cosas. Una vez que termines de leer por completo el material, no dudes en compartirlo en Facebook, Twitter o cualquier otra red social, a fin de que tus seguidores puedan ingresar e informarse al igual que usted.

¿Que es la energía Iónica?
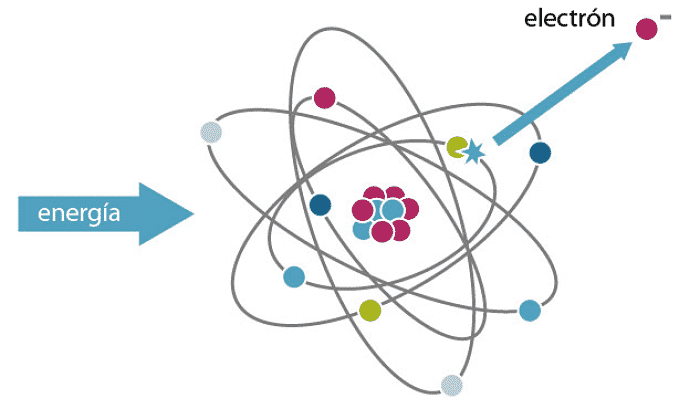
La energía de ionización, también conocida como energía iónica, es la energía requerida para eliminar un electrón de un átomo o ion gaseoso. La primera o energía inicial de ionización (Ei) de un átomo o molécula es la energía requerida para eliminar un mol de electrones de un mol de átomos o iones gaseosos aislados.
Puede pensar en la energía de ionización como una medida de la dificultad de eliminar un electrón o la fuerza con la que se une un electrón. Cuanto mayor sea la energía de ionización, más difícil será eliminar un electrón. Por lo tanto, la energía de ionización está en el indicador de reactividad. La energía de ionización es importante porque puede usarse para ayudar a predecir la fuerza de los enlaces químicos.
También conocido como: potencial de ionización, IE, IP, ΔH °
Unidades: la energía de ionización se mide en unidades de kilojulios por mol (kJ / mol) o voltios de electrones (eV).
¿Cómo funciona la energía iónica?
La ionización, junto con el radio atómico e iónico, la electronegatividad, la afinidad electrónica y la metalicidad, siguen una tendencia en la tabla periódica de elementos.
- La energía de ionización generalmente aumenta el movimiento de izquierda a derecha a lo largo de un período de elemento (fila). Esto se debe a que el radio atómico generalmente disminuye el movimiento a través de un período, por lo que hay una mayor atracción efectiva entre los electrones cargados negativamente y el núcleo cargado positivamente. La ionización está en su valor mínimo para el metal alcalino en el lado izquierdo de la tabla y un máximo para el gas noble en el extremo derecho de un período. El gas noble tiene una cáscara de valencia rellena, por lo que resiste la extracción de electrones.

- La ionización disminuye moviendo de arriba a abajo un grupo de elementos (columna). Esto se debe a que el número cuántico principal del electrón más externo aumenta a medida que avanza un grupo. Hay más protones en los átomos que se mueven hacia abajo en un grupo (mayor carga positiva), sin embargo, el efecto es tirar de las envolturas de los electrones, haciéndolos más pequeños y seleccionando los electrones externos de la fuerza atractiva del núcleo. Se agregan más capas de electrones moviéndose hacia abajo en un grupo, de modo que el electrón más externo se distancia cada vez más del núcleo.
Primera, segunda y subsecuentes energías de ionización.
La energía requerida para eliminar el electrón de valencia más externo de un átomo neutro es la primera energía de ionización. La segunda energía de ionización es la requerida para eliminar el siguiente electrón, y así sucesivamente. La segunda energía de ionización es siempre más alta que la primera energía de ionización. Tomemos, por ejemplo, un átomo de metal alcalino. Eliminar el primer electrón es relativamente fácil porque su pérdida le da al átomo una capa de electrones estable. Eliminar el segundo electrón implica una nueva capa de electrones que está más cerca y más estrechamente unida al núcleo atómico.
La primera energía de ionización del hidrógeno se puede representar mediante la siguiente ecuación:
H (g) → H + (g) + e-
ΔH ° = -1312.0 kJ / mol
Excepciones a la tendencia energética de la ionización.
Si miras un gráfico de las primeras energías de ionización, hay dos excepciones a la tendencia que son evidentes. La primera energía de ionización del boro es menor que la del berilio y la primera energía de ionización del oxígeno es menor que la del nitrógeno.
El motivo de la discrepancia se debe a la configuración electrónica de estos elementos y la regla de Hund. Para el berilio, el primer electrón de ionización potencial proviene del orbital 2s, aunque la ionización del boro implica un electrón 2p. Tanto para el nitrógeno como para el oxígeno, el electrón proviene del orbital 2p, pero el giro es el mismo para todos los electrones del nitrógeno 2p, mientras que hay un conjunto de electrones pareados en uno de los orbitales de oxígeno 2p.
Puntos clave de la energía iónica
- La energía de ionización es la energía mínima requerida para eliminar un electrón de un átomo o ion en la fase gaseosa.
- Las unidades más comunes de energía de ionización son los kilojulios por mol (kJ / M) o los voltios de electrones (eV).
- La energía de ionización exhibe periodicidad en la tabla periódica.
- La tendencia general es que la energía de ionización aumente el movimiento de izquierda a derecha en un período de elementos. Moviéndose de izquierda a derecha a lo largo de un período, el radio atómico disminuye, por lo que los electrones son más atraídos hacia el núcleo (más cercano).
- La tendencia general es que la energía de ionización disminuya el movimiento de arriba a abajo hacia abajo en un grupo de tablas periódicas. Bajando un grupo, se agrega un shell de valencia. Los electrones más externos están más alejados del núcleo con carga positiva, por lo que son más fáciles de eliminar.
Los efectos de las capas de electrones en la energía de ionización
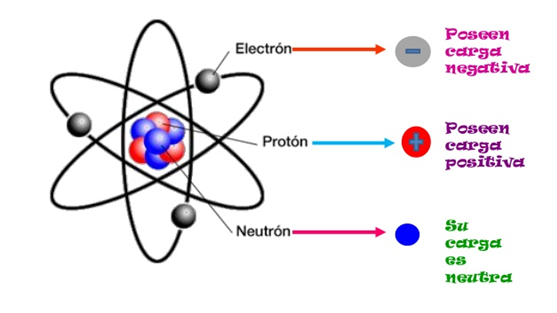
Los orbitales de electrones están separados en varias capas que tienen un fuerte impacto en las energías de ionización de los diversos electrones. Por ejemplo, echemos un vistazo al aluminio. El aluminio es el primer elemento de su período con electrones en la capa 3p. Esto hace que la primera energía de ionización sea comparativamente baja con respecto a los otros elementos en el mismo período, porque solo tiene que deshacerse de un electrón para crear una cubierta de 3s estable, la nueva capa de electrón de valencia. Sin embargo, una vez que ha pasado la primera energía de ionización a la segunda energía de ionización, hay un gran salto en la cantidad de energía requerida para expulsar otro electrón. Esto se debe a que ahora está intentando tomar un electrón de una capa de electrones de 3s bastante estable y completa. Los depósitos de electrones también son responsables del blindaje que se explicó anteriormente.
Predicción de enlaces covalentes e iónicos.
La diferencia de las energías de electronegatividad o ionización entre dos elementos que reaccionan determinan el destino del tipo de enlace. Por ejemplo, hay una gran diferencia de energías de ionización y electronegatividad entre Na y. Cl. Por lo tanto, el sodio elimina completamente el electrón de su orbital más externo y el cloro acepta completamente el electrón, y como resultado tenemos un enlace iónico. Sin embargo, en los casos en que no hay diferencia en la electronegatividad, el intercambio de electrones produce un enlace covalente. Por ejemplo, la electronegatividad del hidrógeno es 2.1 y la combinación de dos átomos de hidrógeno definitivamente hará un enlace covalente (al compartir electrones). La combinación de hidrógeno y flúor (electronegatividad = 3.96) producirá un enlace covalente polar porque tienen pequeñas diferencias entre la electronegatividad.
Ejemplos de ionización
- Nitruro de calcio (Ca3N2)
- Ionización por electrones.
- Solvatación.
- Ionización por electrones.
- Sulfuro de titanio (Ti2S3)
- Disociación del agua.
- Seleniuro de indio (In2Se3)
Esperamos que nuestro articulo les haya sido de gran ayuda y hayan podido entender todo acerca de la energia de ionización. Si tienes alguna pregunta o te quedo alguna duda referida a este tema, no dudes en dejarla debajo en el sector indicado para escribir comentarios, lo leeremos a la brevedad y te daremos la respuesta. Comparte el articulo en tus redes sociales favoritas a fin de que tus amigos y conocidos puedan visitarnos y disfrutar de estos maravillosos temas que tanto interesan.
Hasta pronto!!!
Deja una respuesta